Minden évben megoldom az emelt szintű kémia feladatsort, és az eredményt összevetem a megoldókulccsal, félreérthető kérdéseket, hibás válaszokat keresve. A cél: az emelt szintű kémia érettségi jobbítása, hogy aki ezt a tárgyat választja, azzal a nyugalommal ülhessen be a vizsgára, hogy a követelményeknek teljes mértékben megfelelő, világosan megfogalmazott, megválaszolható kérdésekből álló feladatsort tesznek majd elé. Lássuk, hogy mennyire felelt meg a 2020. májusi feladatsor ezeknek a kritériumoknak!
Durkó Gábor | 2020. május 16.
1. Táblázatos feladat – fémek összehasonlítása
Ez a feladat nem volt különösebben nehéz, az elektronszerkezetre, atomméretre vonatkozó információk a függvénytáblázatban is megtalálhatók, illetve eléggé közismert reakciók egyenleteit kérdezték (Na, Al reakciója oxigénnel, vízzel). Az egyetlen trükkösebb kérdés a nátrium oldódása NaOH oldatban: a fém az oldat víztartalmával reagál, az oldatban levő nátrium-hidroxid nem játszik szerepet a reakcióban, így kiindulási anyagként nem is kell szerepeltetni az egyenletben.
2. Tesztkérdések (egyszerű választás)
A második feladat tesztkérdései közül a 3-as volt valamivel nehezebb. A nitrogén oxidációs számát kellett megállapítani különböző vegyületekben, amelyek közül a NH2Cl (klóramin) és a HCN jelenthetett komolyabb kihívást. Ezeknél ugyanis nem tudjuk az oxidációs számot egyszerű „ökölszabályok” alapján megállapítani: nemcsak a nitrogénre, a klórra és a szénre sincs általános érvényű szabály. Az oxidációs számot a szerkezeti képlet felírásával, és a kötő elektronpároknak a nagyobb elektronegativitású atomhoz való rendelésével tudjuk eldönteni, ez a módszer pedig jóval kevésbé közismert. Bonyolítja a helyzetet, hogy a nitrogén és a klór elektronegativitása (szokás szerint egy tizedesre kerekítve) egyaránt 3,0. A HCN-nél szerencsére egyértelműbb a helyzet, a három kötő elektronpárt a nitrogénhez rendelve megkapjuk a -3-as oxidációs számot, ami mindenképpen a legkisebb az öt felsorolt vegyület közül, akár -2-nek, akár -1-nek vettük a klóramin nitrogénjét.
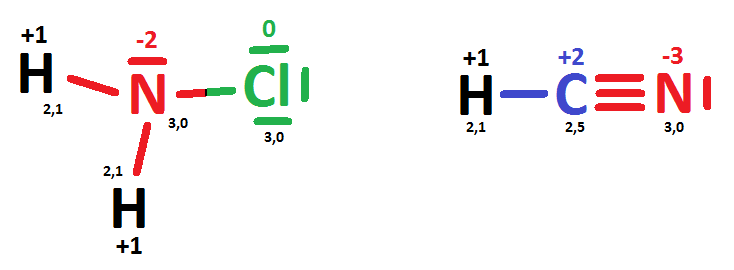
3. Esettanulmány a mosószerekről
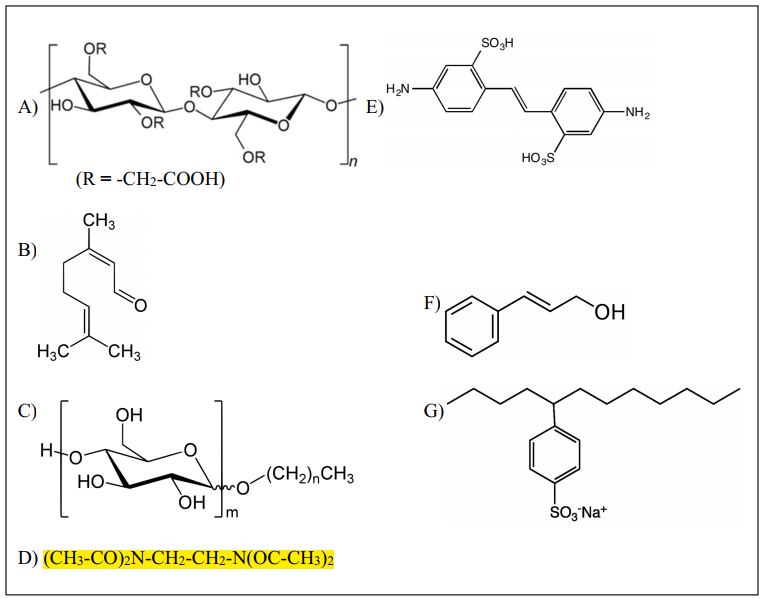
Bár csak 9 pontot ért ez a feladat, meglehetősen tömény volt, tele új kifejezésekkel, vegyületnevekkel. A 7 db képlet beazonosítása a szöveg alapján sok időt és nagyon figyelmes olvasást igényelt a vizsgázóktól, hiszen egyik vegyület sem közismert. A tetraacetil-etilén-diaminnál segítség lett volna egy részletesebb szerkezeti képlet, az acetilcsoport „OC-CH3” formában nem volt könnyen azonosítható. A 2019. májusi feladatsor csokoládéról szóló esettanulmánya egyébként hasonló szerkezetű és nehézségű feladat volt, szintén a szöveg alapján beazonosítható képletekkel.

4. Elemző és számítási feladat – termokémia és egyensúlyok
A feladat számítási része egyszerűen megoldható volt, képződéshőkből kellett három reakció reakcióhőjét kiszámítani. A második részben pedig különböző beavatkozásoknak az egyensúlyra gyakorolt hatását kellett eldönteni. Itt talán az egyensúlyi állandó hőmérsékletfüggése volt a legtöbb gondolkodást igénylő kérdés, a többit a Le Chatelier elv alapján könnyen el lehetett dönteni.
5. Kísérletelemzés – kénsavoldat reakciói
Sok gondolkozást és a reakciók, vegyületek alapos ismeretét igényelte ez a feladat, amelyben különböző anyagokat kellett azonosítani a kénsavval való reakciójuk leírt eredménye alapján. A leírás alapján mindegyik kísérletnél egyértelműen el lehetett dönteni, hogy melyik anyagról van szó, a feladat érdekes volt, bár a sok fejtörés miatt meglehetősen fárasztó. A pontozás szempontjából nem a legjobb ötlet volt, hogy az egyes anyagok reakcióban betöltött szerepénél 4 megadott lehetőség közül kellett választani. Így akkor is 25% a pontszerzés esélye, ha valakinek fogalma sem volt arról, hogy milyen anyag milyen reakciójáról van szó. A feladat szerkezete ismerős lehetett azoknak, akik megoldották az elmúlt néhány év feladatsorait: a 2018. májusi érettségi 5-ös feladata hasonló típusú kísérletelemzés.

6. Számítási feladat: savkeverék és titrálás
Kénsavat és sósavat tartalmazó vizes oldat összetételét kellett meghatározni ebben a számítási feladatban. A HCl mennyiségét a keletkezett AgCl csapadék tömegéből lehetett kiszámolni, utána egy nátrium-hidroxidos titrálás eredményéből lehetett következtetni az oldatban levő kénsavra. Ez a feladat sem okozhatott meglepetést azoknak, akik a korábbi évek feladatsorait megoldották: 2017 óta megszokhattuk, hogy gyakorlatilag minden feladatsorban van titrálási feladat, és ebben a műfajban ez a példa nem volt nehéz.
7. Számítási feladat: ismeretlen szerves vegyület azonosítása
Az általam megkérdezett érettségizők többsége szerint egyértelműen ez volt a legnehezebb számítás a feladatsorban, amivel egyet is tudok érteni. Az azonosítandó vegyület pontos mennyisége nem volt megadva, csak a felhasznált oxigén és az égéstermék térfogata, illetve egy relatív sűrűség, ami nem a legegyszerűbb kiinduló adatsor a számításhoz. Valójában egy gázkeverékes és egy azonosítandó anyagos számítás kombinációjáról van szó. A relatív sűrűségből kiszámítható az égéstermék átlagos moláris tömege és ebből pedig a százalékos összetétele. Utána pedig a szénhidrogén (CnH2n+2) általános égetési egyenletének felírásával, az egyenletből következő mólarányok és feladatban megadott térfogatarányok azonosságának felhasználásával lehetett kiszámolni a szénatomszámot. Ez a fajta, térfogatarányokból való számolás valóban nem tipikus, bár pont a tavalyi feladatsorban volt egy hasonló feladat, ahol szintén egy ismeretlen szénhidrogén képletét kellett meghatározni égetés alapján, nyomásadatokból.
8. Számítási feladat: oldatkészítés és pH-számítás
Tipikus, jól begyakorolható elemekből épült fel ez a számítás. Az anyagmegmaradás alkalmazásán kívül a gyenge bázisokra vonatkozó disszociációs képlet alkalmazására volt szükség. Ezt a képletet rendszerint Kb = x2 / (c – x) formában írjuk fel. Itt egyedül arra kellett jobban odafigyelni, hogy most nem az „x” (azaz a hidroxidionok koncentrációja) az ismeretlen, hiszen azt a 11-es pH-ból közvetlenül ki tudjuk számítani; a hígítási arányhoz a „c”-re, tehát az ammóniaoldat koncentrációjára van szükségünk.
9. Számítási feladat: kristálykiválás és elektrolízis
Ha van két számítástípus, amit az érettségizők nem kedvelnek, az a oldhatósággal (főleg kristályvizes sókkal) kapcsolatos és az elektrokémiai számítás. Ennek az okai megérnének egy külön elemzést, mindenesetre a feladatírók szívesen kombinálják ezt a két feladattípust. A 2019. májusi feladatsorban is volt hasonló – azonban jóval nehezebb – számítás (7. feladat). Ott az elektrolízis hatására kivált sómennyiségből kellett meghatározni az oldhatóságot. Most az oldhatósággal kapcsolatos és az elektrokémiai számítás külön feladatrészben volt, amelyeket egymástól függetlenül is meg lehetett oldani.

A kristályvizes számítás a saját műfaján belül a könnyebbek közé tartozott: ismert összetételű sóból készítettünk ismert töménységű oldatot, ezt akár keverési egyenlettel, akár a felhasznált anyagok tömegének táblázatos nyomonkövetésével meg lehetett oldani. Az elektrokémiai feladatrészben a visszamaradó oldat százalékos összetételének kiszámítása igényelt nagyobb odafigyelést. Itt egy tipikus hibalehetőség a távozott oxigén és réz tömegének levonása helyett az „elbontott vízzel” számolni – ez a megközelítés nem veszi figyelembe, hogy mivel vízbontás csak az anódon történik, a hidrogénionok az oldatban maradnak.
Összegzés
Egy kiegyensúlyozott, a korábbiakhoz hasonló nehézségű feladatsort oldhattak meg a vizsgázók, amely mentes volt a meglepetésektől és az értelmezési problémáktól. A feladatok egyértelmű szövegezésére a tavalyinál is jobban odafigyeltek. Szubjektív értékelésem szerint az elméleti feladatok (főleg az esettanulmány és a kísérletelemző feladat) ezúttal valamivel nehezebbek, a számítások viszont (a 7-es feladatot leszámítva) kicsit könnyebbek voltak a korábbi évek átlagánál.
Kiegészítés szakmai olvasóknak
Az elemzés függelékében arra a néhány pontatlanságra hívom fel a figyelmet, ami azért benne maradt a feladatsorban, illetve van egy elvi dilemmám is a titrálásos számításokkal kapcsolatban.
Pontosan mi is a kérdés? Az 1. (táblázatos) feladat utolsó sorában a „Mi történik vele NaOH oldatban?” megfogalmazás nem egyértelmű – a feladat szövege arra is utalhat, hogy kísérleti tapasztalatokat is fel kell sorolni (pl. gázfejlődés, oldódás, a nátrium megolvadása). Csak a megoldókulcsból derült ki, hogy kizárólag a reakcióegyenlet megadását várták.
Információdömping és egységes képletszerkesztés. A 3. feladat a 9 ponthoz mérten túl sok ismeretlen fogalmat és képletet tartalmazott. A képletek szerkesztésében pedig érdemes lenne egyforma beállításokat használni (pl. betűtípus, kötéstávolságok, betűméretek), a D vegyületet jó lett volna egy áttekinthetőbb szerkezeti képlettel ábrázolni, amelyen látszik a karbonilcsoport.
Milyen színű? – Attól függ… Az 5. (kísérletelemző) feladatnál nem tartom jó ötletnek az elemi vas színét firtatni. Valószínűleg kevés vizsgázónak jut eszébe a „hivatalos” válasz (szürke, fekete), hiszen a vasat a hétköznapokban nem ilyennek látjuk, hanem barnának (a rozsda miatt) vagy ezüstösnek (a horganyzás vagy az ötvözőelemek miatt). Korábban a salétromsav színe generált vitát (színtelen, vagy sárga?), és a nitrobenzol színe is véleményes.

Kell-e ennyi titrálás? A titrálásos számítások mostanában nagyon népszerűek, 2017 óta a feladatsorok többségében van ilyen. Helyenként még visszaméréses titrálások is előfordulnak. Nem vagyok meggyőződve arról, hogy minden, emelt szintre felkészítést vállaló iskolában van lehetősége a diákoknak titrálásokat végezni, vagy akár csak egyetlen titrálást látni és megérteni, hogy mi az a törzsoldat, miért és hogyan veszünk mintákat, mi az az átlagfogyás. Enélkül pedig a dolog fogalmilag a levegőben lóg és a hasznossága kérdéses.
