Szokás szerint idén is megoldottam az emelt szintű feladatsort még a javítási útmutató elolvasása előtt – ez az elemzés a saját és a megoldókulcsban szereplő válaszok összevetéséből született. Összességében a tavalyihoz képest valamivel könnyebb és problémamentesebb feladatsort kaptak a vizsgázók, de egy kérdés azért így is akadt, ahol a megoldókulcs kisebb kiegészítésre szorulna. FRISSÍTÉS: Reagált az Oktatási Hivatal: a réz-szulfátos kérdésnél a csapadékképződés megemlítéséért nem jár pontlevonás (bővebben a cikk végén).
Két esettanulmány?
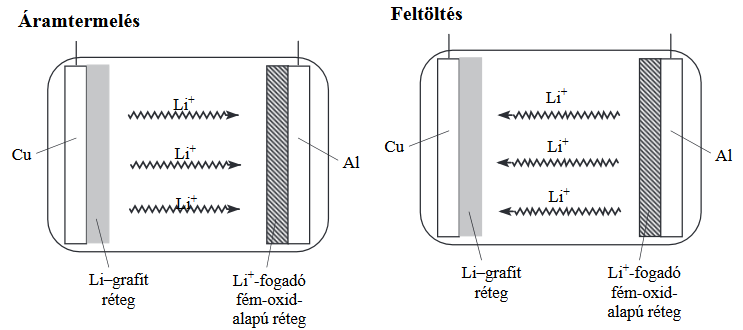
A legérdekesebb talán az volt az idei emelt szintű írásbeliben, hogy a megszokott „esettanulmány” feladaton kívül, ami ebben az évben a méz összetevőivel foglalkozott (2. feladat), volt egy másik, címe szerint „elemző és számítási feladat” (5. feladat), amely szintén elment volna esettanulmánynak. Bár ennél a feladatnál csak 3/4 oldalnyi volt az értelmezendő szöveg, fogalmilag meglehetősen nehéz volt – a lítiumion-akkumulátor működése a kétrétegű elektródokkal eléggé magasra tette a lécet. Az akkumulátorral kapcsolatban az adhatott okot némi fejtörésre, hogy bár az egyik elektród (részben) alumínium, a másik pedig réz, nem ennek a két elemnek a standardpotenciálja alapján dől el, hogy melyik lesz a katód és melyik az anód. Az alumínium ugyan kisebb elektródpotenciálú, de a lényeg a fémre felvitt grafit- illetve fémoxid-rétegben történik: így az oxidáció nem a kisebb standardpotenciálú alumíniumlemezen, hanem a pont a másik elektródon, a rézlemezhez csatlakozó lítiumtartalmú grafitrétegben történik. Szerencsére ez le volt írva a szövegben („a lítiumatomok ionná alakulnak”), így ha másból nem is, ez alapján el lehetett dönteni, hogy ez az elektród lesz az anód, és így a galvánelem negatív pólusa.
A tetrafluoro-borát ion térszerkezetét firtató d) kérdés határeset, hiszen a bór kémiája nem szerepel a követelményrendszerben. A válasz azért kitalálható volt – a periódusos rendszerben az alumínium felett található elemről feltételezhetjük, hogy szintén három vegyértékű, és a fluoridionnal datív kötés kialakítására van lehetőség, ami az ammóniumionhoz hasonló tetraéderes térszerkezetet eredményez. Ennek a kérdésnek a megfogalmazása sem volt a legszerencsésebb – „mi jellemző” az ion térszerkezetére – sokminden lehet jellemző, akár kötéshossz, kötésszög, időbeli változás vagy bármi, bár itt is azért sejteni lehetett, hogy a kérdés egyszerűen csak az, hogy a BF4– ion milyen téralkatú. A c) részben szereplő elektrokémiai számítás nem volt különösebben nehéz.
Nem túl nehéz számítások
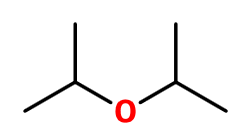
Akár azt is mondhatom, hogy a számítások könnyűek voltak, legalábbis mentesek a komplikációktól. A 9. feladat (gyenge bázis pH-jával kapcsolatos számítás) ebben a témában rutinfeladat volt. A termokémiai számítás (8. feladat) szintén gyorsan megoldható, itt talán a diizopropil-éter képletének felírása jelenthetett minimális kihívást, hiszen az izopropilcsoport nem gyakran kerül említésre, és ez a molekula pont nem szerepel a függvénytáblázatban sem. De ha valaki esetleg izopropil helyett propilcsoporttal számolt volna, akkor is ugyanaz az összegképlet, és így a feladat végeredménye is.
A számítások közül a 7. feladat volt talán a legnehezebb, az ismeretlen összetételű szén-monoxid – oxigén eleggyel, azonban ha valaki látott már hasonló feladatot (az elmúlt években nem egy ilyen volt), ezt is különösebb komplikáció nélkül meg lehetett oldani. A tavalyi metán + vízgőzös feladat (2015. május / 9. feladat) ennél jóval nehezebb.
A 6. feladat szintén viszonylag könnyen megoldható volt, hiába négykomponensű a fémkeverék, minden reakcióval egy-egy komponens mennyiségét közvetlenül meg lehetett határozni – a lúggal csak az alumínium, a megmaradt három elem közül a híg savval csak a vas, a következő lépésben a salétromsavval csak az ezüst reagál. Az ezüst és a „közepesen tömény” salétromsav nitrogén-monoxidot eredményező reakciója érettségin emlékeim szerint még sohasem került elő, valamiért ezt a reakciót mindig rézzel szokták felírni, az ezüst esetében meg mindig NO2-vel, de pont a réz hasonló reakciói és a NO tulajdonságainak körülírása miatt („színtelen gáz, ami a levegővel érintkezve megszínesedik”) azért ezt is ki lehetett találni.
A kedvenc: réz-szulfát és ammóniaoldat, egy kis problémával
A réz(II)-tetraamminkomplexe szinte minden évben előkerül valamilyen formában – az idei év sem volt kivétel, ezúttal a 4. feladatban (kísérletelemzés) szerepelt. Ez volt talán az egyetlen olyan kérdés, ahol a válasz nem egyértelmű. A feladat d) kérdése egy kísérletet ír le, amikor ammóniát tartalmazó üveghengerbe réz-szulfát oldatot öntünk, a vizsgázónak kell megadnia, hogy mit tapasztalunk, és felírni a reakcióegyenleteket.
A hivatalos válasz szerint a réz-tetraammin-komplex sötétkék színét látjuk, ami a rézion + ammónia között lejátszódó reakció eredménye.

Mielőtt rátérnék arra, hogy mi a baj ezzel a válasszal, nézzük meg röviden a réz-tetraammin kémiáját. A réz-szulfát – ammónia reakcióval kapcsolatos „standard” kísérletek, amelyek különböző variációkban a szóbeli vizsga kísérletei között is szerepelnek, a következők:
1) réz-szulfát oldathoz ammóniaoldatot csepegtetünk
2) ammóniaoldathoz réz-szulfát oldatot csepegtetünk
Mi történik ilyenkor? A rendszerben két reakció játszódhat le, az egyik a hidroxidcsapadék képződése. Mivel az ammóniaoldat lúgos, a réz(II)-ionok a hidroxidionokkal rosszul oldódó, stabil réz(II)-hidroxidot képezhetnek. Ilyenkor azt tapasztaljuk, hogy az oldatból világoskék színű csapadék válik ki. A másik folyamat, ami lejátszódhat, a réz(II)-ionok és az ammónia komplexképződési reakciója, ami mélykék színű réz-tetraamminkomplexet eredményez.
Mind a csapadék, mind a komplex képződése egyensúlyi folyamat, és valójában párhuzamosan mind a kettő lejátszódik. A komplex azonban stabilabb, így ha van elég ammónia az oldatban, az egyensúly nagymértékben a kompexképződés irányába tolódik el, az oldatból elfogynak a szabad rézionok, ami a csapadék gyors feloldódását eredményezi.
Mit tapasztalunk tehát? Ha sok réz-szulfát oldathoz kevés ammóniaoldatot adunk, akkor csapadék képződik (hiszen még nincsen elég ammónia a rézionok mennyiségéhez képest, viszont az oldat már kevés ammóniától is lúgos). Ha a csapadékos oldathoz további ammóniát adunk, akkor a világoskék réz(II)-hidroxid-csapadék feloldódik, és a réz-tetraamminkomplex mélykék színét láthatjuk.
Ha az ammónia már a kezdet kezdetén feleslegben van – és ez a helyzet a „2)” esetben, amikor ammóniaoldathoz adagoljuk a réz-szulfátot – akkor csapadékképződést nem látunk, hiszen az ammóniafelesleg miatt azonnal kialakul a komplex.
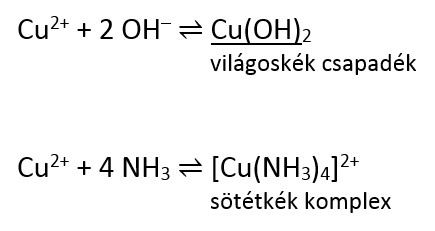
És itt térek vissza az érettségi 4. feladatának ezzel kapcsolatos kérdésére. Az ammóniagáz és a réz-szulfát oldat reakcióját ugyanis nem mondanám „standard” kísérletnek. Az ammónia itt gázfázisban van, és bár közismerten rendkívül jól oldódik vízben – és persze réz-szulfát-oldatban is – kezdetben azért a réz-szulfát oldatban az ammónia koncentrációja nulla. A folyadékban való feloldódása során könnyen lehet, hogy kezdetben csapadék is képződik, amíg a beoldódott ammónia mennyisége (koncentrációja) el nem éri a komplex kialakulásához szükséges mértéket. A megoldókulcs azonban csak a komplexképződési reakciót és a sötétkék színt adja meg. Itt helyes válaszként el kellene fogadni azt is, hogy kezdetben kiválik a világoskék színű réz-hidroxid csapadék, ami azonban gyorsan feloldódik. Persze lehet, hogy az ammónia oldódása olyan gyors, hogy a csapadék képződését egyáltalán nem is látjuk, mert azonnal feloldódik – ezt a laborban kellene kipróbálni – de pont azért, mert ez nem tartozik a „standard” réz-tetraamminos kísérletek közé, nem várható el az érettségizőtől, hogy ezt kitalálja (mellesleg nem is biztos, hogy így van).
Alternatívák a megoldókulcsban
Pozitívum, hogy a megoldókulcs több esetben is megad alternatív helyes válaszokat, amelyek közül számomra a legszórakoztatóbb a fenolftalein „színeinek” felsorolása – a hivatalos „bíborvörös” mellett immár (nagyon helyesen) a lila, piros vagy ciklámen szín is elfogadható. Ezt a témát már korábban körüljártuk, Villányi Attila tanár urat is megkérdeztük – talán nincs még egy olyan indikátor, aminek az egyfajta színét több különböző szem többféleképpen látná, szerencsére az idei megoldókulcsban már körültekintően az összes lehetőség szerepel.
A 4. feladat megoldásánál is elgondolkoztam, hogy az ammónium-kloridból ammónia felszabadítására alkalmas szilárd anyagok közül vajon melyikre gondolhatott a feladatíró – gyakorlatilag bármelyik erős bázis megfelelő -, de szerencsére a javítókulcsban itt is előrelátóan több alternatíva szerepelt.
Összegzés
A tavalyihoz képest mindenképpen könnyebb volt a feladatsor, elsősorban a számítási feladatokat tekintve. Az elektrokémiai „második esettanulmány” viszont fogalmilag meglehetősen nehéz, de érdekes feladat volt. Idén csupán egyetlen olyan kérdést találtam, aminél a javítási útmutatót korrigálni kellene: a 4. feladat d) részénél (ez volt a réz-tetraamminos feladat) annak a válasznak is elfogadhatónak kellene lennie, hogy a kezdetben kiváló világoskék csapadék mélykék színnel gyorsan feloldódik.
Válaszolt az Oktatási Hivatal
A réz-tetraamminos feladattal kapcsolatos felvetésemet ma reggel megírtam az Oktatási Hivatalnak, amire néhány órán belül már meg is érkezett a megnyugtató válasz a Kémia tételkészítő bizottságtól:
„Természetesen az így megfogalmazott válasz is teljes értékűnek tekinthető”
Nem veszít tehát pontot az, aki a 4. feladat d) részénél a fent leírtak szerint (a komplexképződés mellett) a csapadékképződést is megemlítette.
A fenoftalein színének a rózsaszínt elfogadják?
én elfogadnám azt is
Nagyon jó elemzés, nekem is ezekkel a pontokkal akadtak problémáim. Az általad felvetett javítási javaslatokat meg szokták fogadni? Boldog lennék, ha a réz-szulfátos feladatnál elfogadnák azt a választ, amit te is leírtál.
Írtam az OH-nak a réz-szulfát ügyében, ha reagálnak, frissítem a cikket
Már meg is jött a válasz: elfogadják a cikkben leírt gondolatmenetet is, nem jár pontlevonás a csapadékképződés megemlítéséért
Ezek szerint akkor utólag megváltoztatják a megoldókulcsot és a réz-II-hidroxid csapadék képződését is elfogadják? Akkor a már kijavított érettségi dolgozatokban visszamenőleg megadják azoknak a pontot ,akik a Cu(OH)2-t írták? Ha esetleg nekem nem fogadnák el,akkor érdemes fellebbezni?
Köszönöm a választ előre is.
Igen, elfogadják, ha ott van a komplexképződés is (ami a megoldókulcsban szerepel), azaz, hogy a kezdetben kiváló réz-hidroxid csapadék feloldódik. (Önmagában a réz(II)-hidroxid képződése továbbra sem jó válasz.)
Köszönöm szépen!!!!! 🙂
Kedves Gábor!
Ha a keverékes feladatban rögtön az a.) feladatban elrontottam az alumínium reakciójának egyenletét, és emiatt rossz molaránnyal számoltam a továbbiakban, akkor van-e esély arra, hogy csak erre az egy feladatrészre vonjanak le pontot? Vagy ez elvi hibának számít? A feladat többi része jó lett, a többi egyenlet és számolás is rendben van, de mivel az alumínium tömegére hibás eredmény jött ki, több minden elcsúszott a továbbiakban, pl. a tömegszázalékos összetétel.
Köszönöm a választ!
Elvi hibának számít, de ilyenkor is csak az adott feladatrészre járó pontokat veszíted el. A többi pont jár, feltéve, hogy a hibás adattal való további számolás nem vezetett ellentmondásra.
Úgy gondolom én is, hogy nem volt nehéz az érettségi idén. Nekem 92 pontos lett, amivel nem vagyok túl elégedett, sok pontot hagytam ott figyelmetlenség miatt sajnos.
Azzal egyetértek, hogy a számolások nagyon egyszerűek voltak, szerintem középszinten is elmentek volna, bár nem tudom, hogy ott tananyag-e a gyenge bázis-gyenge sav témakör.
Kedves Gábor!
A 7-es feladat b részében elfelejtettem rendezni az egyenletet,viszont a hibás adattal jó a számolásom. Esetleg ott adható valamennyi pont?
Koszonom!
Igen, az csak kisebb elvi hibának számít, ha egyébként az egyenlet helyes.
Ilyenkor a hibás adattal helyesen számolva a további pontokat meg kell hogy adják. Bár az egyenletre nem járt külön pont, tehát egy pontot valószínűleg mindenképp levonnak a hibás eredményért.
Az első táblázatos feladatban a 9. és 10. kérdésre, miszerint a vegyületek vízben való oldhatóságára kérdeztek rá, ott azt írtam,hogy „oldódik”és „jól oldódik”,erre nem kaptam pontot.A megoldókulcsban mindkét helyen az szerepel,hogy „korlátlan(elegyedik)”. Megfellebbeztem,jogosan tettem? Ha nem,akkor miért?
Köszönöm a válaszokat.
A „jó oldódás” és a „korlátlan elegyedés” között nem csak megfogalmazásbeli, hanem tartalmi különbség van, tehát nem biztos, hogy elfogadják. Fellebbezni azért lehet 🙂
Kedves Gábor,
Örülök, hogy a 9. feladat rutin a mai középiskolai oktatásban, azonban a megoldás sokkal összetettebb, mint a megoldókulcs sugall. Ezek szerint szerinted is, mert egyet értettél ezzel.
A feladat egyértelműen úgy fogalmaz, hogy közömbösítjük (= pH7). Mivel gyenge bázisról van szó így természetesen az equivalencia pont a savas tartományban van (pKb=3.43 esetén ~pH5,92). Tehát a közömbösítési (pH7) pontra a Henderson-Hasselbalch egyenletet kell alkalmazni. Mivel sem a pKb-t sem a Cb-t nem ismerjük, így a feladat elvileg nem oldató meg Ráadásul elég híg a bázis a semleges pH-n ezért talán a víz disszociációt is bele lehetne venni, ami a második tizedest módosíthatja. Ennek így a matematikája is lassan a tagozatos szintet súrolja.
Ennek a feladatnak a nehézsége vetekszik a piridin brómozásának problémájával, ami Bruckner szerint éppen nem a megoldókulcsban szereplő kinetikával megy végbe, na de ezt is tudni kellene, de bajunk van a Li, Be vegyértékeivel.
Véleményem szerint ez nem középiskolás szint volt.
Üdv
Kedves Szidor!
A feladatban nem szerepelt, hogy a közömbösítés pH 7-ig történne. A közömbösítés fogalma azt jelenti, hogy ekvivalens anyagmennyiséget reagáltatunk a savból és a bázisból. A 9-es feladatnál a keletkező só hidrolízise miatt ez valóban nem jelent semleges kémhatást (pH 7), de a titrálásnál a megfelelően kiválasztott indikátor az ekvivalenciapontnál jelez, nem pedig pH 7-nél. Ezért itt a pufferoldattal nem kell számolni.
Azt nem állítottam, hogy ez a feladat úgy általában a középiskolások számára rutinfeladat lenne, inkább csak az adott témakörben tartom annak. De egyáltalán nem vagyok biztos benne, hogy ez a témakör mindenütt sorra kerül az iskolai kémiaórákon. Az érettségi követelményeknek viszont megfelel.